HOME > 分担研究概要 > 個別化医療のための分子イメージング技術を用いた癌抑制遺伝子の機能解析
分担研究概要

個別化医療のための分子イメージング技術を用いた癌抑制遺伝子の機能解析
千葉 奈津子
加齢医学研究所 遺伝子制御研究部門 免疫遺伝子制御研究分野 准教授
E-mail:![]()
1. はじめに
わが国における死亡の第一位は悪性腫瘍によるものであり、全死亡の約3分の1が悪性腫瘍で死亡しているのが現状である。一方、近年の悪性腫瘍の治療法の進歩により、悪性腫瘍の約60%が治癒する時代になったとされる。さらに、分子生物学の進歩は、多くの癌関連遺伝子の同定を可能にし、遺伝子レベルでの解析が進展している。また、マイクロアレイに代表されるポストゲノム時代の遺伝子解析も発展しており、これらにより、癌の発症機構を分子レベルで解明するのみならず、臨床の場における遺伝子診断、新たな分子標的の探索などへの発展に期待がよせられている。
2. 家族性乳癌原因遺伝子BRCA1の機能解析とその応用
現在我々は、家族性乳癌原因遺伝子であるBRCA1の機能解析を行っている。BRCA1は、1994年、三木らにより単離された癌抑制遺伝子である(1)。BRCA1生殖細胞変異による乳癌発症リスクは約80%、卵巣癌発症リスクは約40%と推定されており、散発性癌に比較して若年発症で、両側乳癌や多臓器重複癌の頻度が高く予後不良であるとされる。
一方、散発性癌ではBRCA1遺伝子変異をほとんど認めないため、当初、散発性癌におけるBRCA1の発癌機構における役割は少ないと考えられた。しかし、その後の解析により、散発性乳癌の30%、散発性卵巣癌の70%でBRCA1のmRNAやタンパク発現が減少し、その頻度は悪性度の高いものほど高く、また、それらの癌でBRCA1遺伝子がメチル化されていることが報告された。よって、BRCA1の機能低下が、散発性癌の発症機構や薬剤耐性機構にもBRCA1が関与することが推察される。
BRCA1は、転写制御、DNA修復、細胞周期制御などの細胞内の多様な機構に関与することが明らかとなっており、その中で癌抑制遺伝子としてDNA修復能が特に注目されている(2)。
我々はこれまでの研究により、(1)BRCA1を含む4つの異なるタンパク複合体の分離に成功し、BRCA1の多様な機能が多様な複合体の形成によって行われること(3)、(2) 細胞周期のS期における核内foci形成や、RNAポリメラーゼIIホロ酵素との相互作用に必要な、BRCA1のドメインを明らかにした(4)。また、(3)BRCA1のアポトーシスと細胞増殖への関与を示し(5)、(4)BRCA1の有するユビキチン化能の新たな基質としてRNAポリメラーゼIIを同定に成功した(6)。RNAポリメラーゼIIは、紫外線照射後、BRCA1によりユビキチン化され、その後プロテアソームにより分解されることを示し、そのユビキチン化能と転写共役修復への関与を示し、DNA障害後、RNAポリメラーゼIIがBRCA1の作用により分解され、転写が停止し、さらにBRCA1がDNA修復因子をリクルートすると考えられた(図1)。
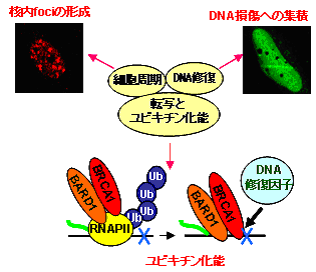
図1.BRCA1は細胞内の多様な機構に関与する
さらに現在は、上記の研究を発展させることに加えて、東北大学加齢医学研究所、遺伝子機能研究分野、安井明教授との共同研究により、分子イメージング技術を用いて、生細胞内のDNA損傷に対する反応をリアルタイムで解析する実験系を用いて、BRCA1のDNA修復における役割を検討している。
このシステムは、照射用レーザー(365nm, 405nm)と共焦点レーザー顕微鏡からなり、生細胞核にDNA単鎖切断、二重鎖切断、塩基損傷などのDNA損傷を作製し、リアルタイムで解析することができる(図2)。365nmの色素レーザーは線量をパルスの数とフィルターで制御し、405nmの半導体レーザーは、連続光で線状に照射し、線量はレーザー出力の制御とスキャン回数で制御している。抗体を用いて内因性のタンパク質の集積と解離を解析することに加え、変異体や抗体の得られないタンパク質の解析には、GFP(green fluorescence protein)などの蛍光タンパク質を融合したタンパクを細胞に発現させて解析している(7−9)。
現在、DNA 損傷への集積のパターンと他のDNA修復タンパクの欠損細胞を用いた解析より、さまざまなDNA 損傷に対するBRCA1の集積のメカニズムを明らかにしつつある。
また、我々は、プロテオミクス解析を用いてBRCA1やその関連分子と相互作用する分子の同定行っており、DNA損傷への反応を検討しており、薬剤感受性への影響なども検討している。
近年、BRCA1欠損細胞が、DNA 単鎖切断の修復に関わるpoly(ADP-ribose)polymerase(PARP)に対する阻害剤に感受性であることが判明した(10)。これは、細胞内の複数のDNA修復経路の中で、BRCA1が関与するもの以外の系を阻害することで、BRCA1欠損細胞のみに強い細胞毒性を起こすことができるということである。散発性癌の一部でもBRCA1の発現が低下していることより、BRCA1のDNA修復能に関する詳細な解析により、家族性乳癌、卵巣癌だけでなく、散発性癌にも有効な新たな治療薬となる分子標的を探索することが可能になると考えられる。
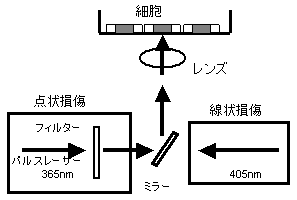
図2.レーザー照射システム(文献(9)より改変)
3. おわりに
今後は、これまでのBRCA1の研究に加え、さまざまな腫瘍関連分子に着目し、分子イメージング技術などの新しい技術を用いて、それらの機能を詳細に解析することにより、発癌や再発のリスク評価、薬剤感受性の予測、治療のための新たな標的分子探索に関する研究を展開したいと考えている。また、細胞内タンパク群の動態を解析するために、タンパク発現、相互作用、翻訳後修飾や、目的タンパク質の精製・同定などを効率的に行える実験系の開発もめざしている。
文献
[1] Miki Y, ほか45名. Science 266, 66-71, 1994
[2] 千葉奈津子, 石岡千加史, 日本臨床, 65-6, 601-605, 2007.
[3] Chiba N and Parvin JD. J Biol Chem 276-42, 38549-38554, 2001.
[4] Chiba N and Parvin JD. Cancer Res 62, 4222-4228, 2002.
[5] You F, ほか5名. Oncogene, 23-34, 5792-5878, 2004.
[6] Starita LM. ほか5名. J Biol Chem 280-26, 24498-505, 2005.
[7] 蘭利, ほか2名. 実験医学 24-3, 364-370, 2006.
[8] Lan L, ほか7名. Proc Natl Acad Sci USA 101-38, 4153-4162, 2004.
[9] Lan L, ほか6名. J Cell Sci, 118, 13738-13743, 2005.
[10] Farmer H, ほか13名. Nature 434, 917-921, 2005.