HOME > 分担研究概要 > 機能性ナノ粒子を用いた極限の画像計測と医療応用
分担研究概要

機能性ナノ粒子を用いた極限の画像計測と医療応用
大内 憲明
医学系研究科 医科学専攻 外科病態学講座 腫瘍外科学分野 教授
E-mail:![]()
1. はじめに
近年、ナノメートルオーダーの物質制御技術(=ナノテクノロジー)は著しく進歩し、従来の常識からは考えられない高機能なナノ粒子、ナノデバイスの開発が急速に進みつつある。ナノテクノロジーは医療分野への応用も試みられ、有望な技術が次々に開発され、医療における大きな潮流である個別化の推進や、より高度な診断・治療への利用が広がっている。ナノテクノロジーの応用領域として、Drug Delivery System (DDS) が第一に挙げられ、薬剤の到達経路解明による、より高効率な薬剤、高機能なナノ粒子を用いた高度な診断法、治療法の開発が強く期待されている。ナノテクノロジーの応用は、人工臓器や新しい手術法など他の医療分野においても同様に期待され、医療技術を革新する潜在的な力を持つ。このような時代の大きな変化を背景に、我々はナノ粒子を用いた新しい計測技術を開発し、医療への応用を検討してきた。本稿ではわれわれが取り組んでいる、機能性蛍光ナノ粒子を用いた、従来の限界を超えた計測技術について概説する。
2. 機能性ナノ粒子の開発と極限的計測法
2.1 抗がん薬の一粒子イメージング
近年分子1個を識別、追跡することで薬物動態を明らかにする手法が注目されている。従来、蛍光粒子を用いた1分子計測は蛍光色素の蛍光強度不測や装置の感度不測のため計測が困難であった、一粒子計測を実現する方法として、量子ドットを用いた蛍光計測が挙げられる。我々は量子ドットを分子マーカーとし、独自に開発した超高感度蛍光計測システム(図1)を用いて生体内の薬物動態の計測を試みた。この研究において、乳癌細胞に発現したHER2タンパクに対する単クローン抗体と量子ドットの結合物を作製し、生体投与後の体内動態の計測を試みた。その結果、担癌マウスの血管内から腫瘍間質、がん細胞、さらに細胞内の一分子の動きを世界で初めて検出することに成功した(図2)。
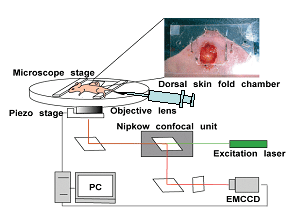
図1. 超高感度1分子計測装置
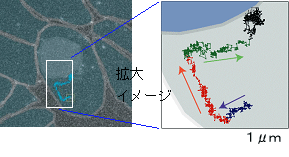
図2. 細胞内の量子ドット−単クローン抗体結合物の運動
2.2 超音波変調による深部蛍光色素の検出
現在がん手術において、不要なリンパ節郭清を省略する目的で行われるセンチネルリンパ節生検法は、低侵襲な個別化医療を実現する手法として期待されている。現在色素法やラジオアイソトープ法が最も一般的に行われているが、色素法は体外からの識別ができないことや、RI法は利用施設が限定されるなどの欠点を有する。我々は、どの施設でも利用可能なセンチネルリンパ節検出法として、ナノサイズ蛍光粒子を用いた蛍光法の開発に取り組んできた。最適なサイズを持つナノ粒子はセンチネルリンパ生検を効率よく行う上で有用と考えられる。従来の蛍光計測法は深部宝庫の計測に限界があり、体表から深部に存在する蛍光色素の位置情報検出は困難であった。我々は超音波変調により、乳がんのセンチネルリンパ節生検においてほぼ実用的と考えられる深度の蛍光色素検出に成功した(図3)。
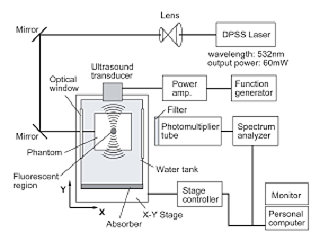
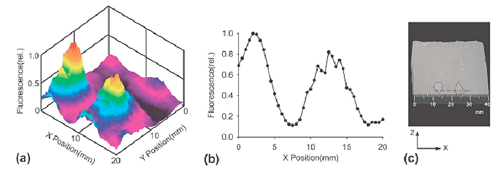
図3. 超音波変調法実験装置(上)による光散乱媒体中の深部蛍光色素の位置検出(下)
3. 機能性ナノ粒子を用いた極限的計測法の展望
本研究で開発した蛍光1分子計測法により、従来in vitro、もしくはmassでしか知ることのできなかったDDSの情報を分子レベルで直接計測可能であり、きわめて詳細なDDS、更には生体内の信号伝達の解明が期待される。これにより、有効な病変到達性を持つ薬剤の開発や基礎医学研究に大きく貢献すると考えられる。
超音波変調法による蛍光計測法は従来行われてきたセンチネルリンパ節生検法の欠点を補い得る検査法と考えられる。臨床応用に至る前に 動物実験による有用性の検証や、装置の最適な仕様の検討を行う必要はあるが、基盤技術としてきわめて有望である。以上のように、従来にない有用な物性を持つナノ粒子を利用した新しい計測技術はこれまで不可能であった計測を可能とし、将来医療に変革をもたらすと考えられる。
4. おわりに
急速に発展しつつあるナノテクノロジーをナノ医療に取り入れる橋渡し研究は、工学分野、医学分野それぞれ単独で推進することはできない。また、研究者がそれぞれの分野を個別に学んでも有効にナノ医療を推進することは不可能であり、複数領域の研究者が場を1つにして共通の言葉で話し合える環境、共通の言葉・知識を学ぶ組織の構築が次代の研究を担う人材育成上最も重要である。我々はこれまで述べた研究を通じ、大学院生、ポスドクに異分野融合研究と教育の場を与え、医学・工学双方の素養を持つ研究者を育成する予定である。
文 献
[1] Takeda M, Kobayashi M, Takayama M, Suzuki S, Ishida T, Ohnuki K, Moriya T and Ohuchi N. Biophoton detection as a novel technique for cancer imaging. Cancer Science 95 (8), 656-661, 2004
[2] Kasuya A, Sivamohan R, Barnakov YA, Dmitruk I M, Nirasawa T, Romanyuk VR, Kumar V, Mamykin SV, Tohji K, Jeyadevan B, Shinoda K, Kudo T, Terasaki O, Liu Z, Belosludov RV, Sundararajan V, Kawazoe Y. Ultra-stable nanoparticles of CdSe revealed from mass spectrometry. Nature Materials 3, 99-102, 2004.
[3] Nakajima M, Takeda M,Kobayashi M, Suzuki S, Ohuchi N. Nano-sized fluorescent particle as a new tracer for sentinel node detection: An experimental model for decision of appropriate size and wavelength. Cancer Science 96 (6), 353-356, 2005.
[4] Zhou X, Kobayashi Y, Ohuchi N, Takeda M and Kasuya A, Strong luminscence of CdSe nanoparticles by surface modification with gadmium (II) hydrous oxide. International Journal of Modern Physics B 19, 2835-2840, 2005.
[5] Kasuya A, Noda Y, Dmitruk I, Romanyuk V, Tohji K, Kumar V, Belosludov R, Kawazoe Y, Ohuchi N. Stoichiometric and ultra-stable nanoparticles of II-IV compound semiconductors. Eur Physical Journal D 34, 39-41, 2005.
[6] Tada H, Watanabe T, Higuchi H, Ohuchi N. In vivo real-time tracking of single quantum dots conjugated with monoclonal anti-HER2 antibody in tumors of mice. Cancer Res, 67 (3), 1138-44, 2007.
[7] Park YS, Liz-Marzan LM, Kasuya A, Kobayashi Y, Nagao D, Konno M, Mamykin S, Dmytruk A, Takeda M and Ohuchi N, X-ray Absorption of the Gold Nanoparticles with Thin Silica Shell. J Nanosci Nanotechnol 6 (11), 3503-06, 2006.
[8] Mamykin S, Kasuya A, Dmytruk A, Ohuchi N. Photocurrent of nanoassembled Si film in contact with electrolyte. J Alloys Compounds 434-435, 718-720. 2007.
[9] 樋口秀男, 大内憲明. 量子ドットを用いたがん細胞の分子ナノイメージング. Medical Bio November, 55-59, 2007.