分担研究概要

内耳のバイオメカニクス
和田 仁
工学研究科 バイオロボティクス専攻 バイオメカニクス講座
生体機械工学分野 教授
E-mail:![]()
1. はじめに
図1にヒトの聴覚器官の模式図を示す.空気の疎密波である音は,外耳道から入射し,鼓膜を振動させる.鼓膜の振動は中耳に存在する耳小骨連鎖を経て,内耳の蝸牛へと伝達される.蝸牛は螺旋状の器官であり,内部はリンパ液で満たされている.蝸牛内の基底板と呼ばれる膜の上には,感覚細胞である内有毛細胞(Inner Hair Cell : IHC)と外有毛細胞(Outer Hair Cell : OHC),および数種類の支持細胞で構成されるコルチ器が存在し,これらは蓋膜で覆われている.
中耳を経て蝸牛へ伝えられた音刺激は,リンパ液を介してコルチ器を振動させる.IHCは,機械-電気変換の役割を担っており,基底板の振動を感知し,聴神経にインパルスを発生する.その信号は脳へと伝えられ,我々は音を認識する.一方,OHCは音刺激に応じて自身の細胞長を変化させる.OHCが伸縮運動する際に発生する力は,コルチ器の振動を増幅させると考えられている.つまりOHCは増幅器の役割を果たし,聴覚を鋭敏にする役割を担っている.この増幅機構により,ヒトは小さい音でもはっきりと認識することが出来る.OHCの伸縮運動の源は,細胞側壁に密に存在するタンパク質モータ"prestin"の構造変化であると推察されている.Prestinはピエゾ素子と同様の特性を有する,高性能なタンパク質モータであると考えられている.
我々は以下の研究を行っていく.(1) OHCのタンパク質モータprestinの構造解明とprestinを動力源とする新型アクチュエータの開発.(2) 内耳に発現する膜タンパク質の遺伝子変異に由来する難聴の新規治療法の開発.(3) 有限要素法を用いたコルチ器の振動挙動の解析.
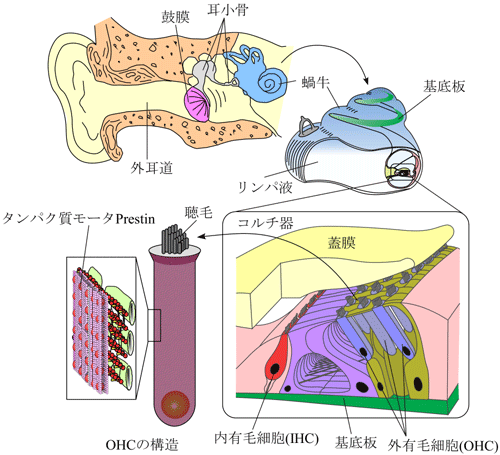
図1. ヒトの聴覚器官の模式図.
2. タンパク質モータprestinに関する研究
2.1 Prestinの構造解明
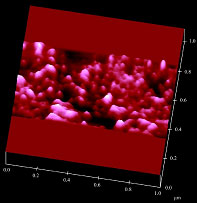
図2. Prestinを発現させた細胞の
細胞膜の原子間力顕微鏡画像.
Prestinは744アミノ酸からなる膜貫通型タンパク質で,陰イオン輸送体の一種であると考えられている.本研究では,prestinの構造解明を目指している.図2は, prestinを発現させた細胞の細胞膜の原子間力顕微鏡による観察画像である.数 nm〜数十 nmの粒子状構造物が観察された.これらの画像を解析することにより,prestinの直径が8-12 nmであることを明らかにした[1].今後は,原子間力顕微鏡を用いて,精製したprestinをより高分解能で観察し,prestinの3次元構造の解明を目指す.
2.2 Prestinを動力源とする新型アクチュエータの開発
細胞膜電位の変化に忠実に同期するOHCの伸縮運動は,100 kHzにまで及ぶ驚異的に高い応答性,長さ50 μmの細胞において約20 nm/mVと人工圧電素子のそれの1万倍におよぶ非常に高い電気−機械変換効率,ATP非依存で電位をエネルギー源とする,というユニークな特性を有する.我々は,このような極めて高性能な外有毛細胞の伸縮運動の源であるprestinを動力源とする,新型バイオマイクロアクチュエータの開発を目指している.本研究では,精製したprestinを脂質膜に再構成することにより,生体分子で構成され,電位変化に応じて変形する素子の開発を試みる(図3).この素子は,生体親和性のよい新型バイオマイクロマシンの構成要素となることが期待される.
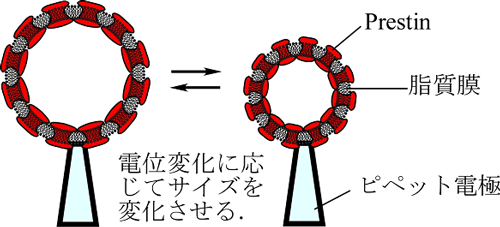
図3.Prestinを動力源とする電位可動性脂質膜.
3. 変異膜タンパク質救出法による遺伝性難聴の新規治療法の開発
高度難聴児は新生児1,000人に1人の割合で誕生するとされ,難聴は先天性疾患のうち最も頻度の高い疾患の1つである.先天性難聴の少なくとも半数は遺伝子に関係すると考えられている.ギャップジャンクションを構成するconnexin26や,塩素・ヨウ素輸送タンパク質であるpendrin等の膜タンパク質の遺伝子変異の一部は,発現する膜タンパク質のミスフォールディングによる機能不全を起こさせると考えられている.
我々は,pendrinの同族体であるprestinを研究対象とし,ミスフォールディングにより機能不全に陥った変異prestin [2]を発現する細胞に,分子シャペロンとして働きprestinの構造を正す試薬を添加すると,変異prestinの機能が回復することを示してきた.本研究ではこの知見を活用し,タンパク質の構造を正すのを助ける物質を投与することにより,変異タンパク質の構造と機能を回復させる,遺伝性難聴の新しい治療法の開発を試みる.
4. 有限要素法を用いた聴覚器官の振動挙動解析
コルチ器の動的挙動の解明は,聴覚器官の機械-電気変換機構を理解するに当たり,重要であると考えられる.しかし,コルチ器は脆弱な器官であり,その振動振幅が微小であるため,振動様式を実験で観察することは困難である.そこで,我々が独自開発した聴覚器官の解析に特化した有限要素法プログラムを用いて,図4に示すアレチネズミ蝸牛基部のコルチ器の有限要素モデルを構築し,コルチ器の動的挙動の解析を行った.その結果,コルチ器は内部構造を保ち剛体として振動していることが明らかになった.また,コルチ器の振動と聴神経インパルス発生の周波数特性を明らかにした[3].
今後OHCの伸縮運動をモデルに導入し,その伸縮運動がコルチ器の振動に与える影響の解析を試みる.本研究により,聴覚器官の音受容メカニズムの解明,及び病変がそれに与える影響を明らかにすることを目指す.
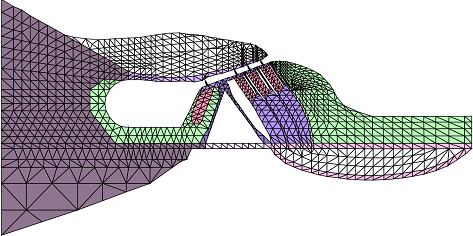
図4. コルチ器の有限要素モデル.
おわりに
以上の通り,ライブイメージング等の分子生物学的細胞観察技術,細胞内小器官のバイオメカニクス的計測技術およびミクロな力学環境操作のためのバイオMEMS技術を高度に融合させ,特に次の項目に着目して細胞応答性の評価を行う.(1)細胞および細胞骨格構造の形態,(2)細胞骨格タンパク質,接着タンパク質など分子レベルの移動・分布,(3)細胞内小器官の力学特性,(4)細胞内部の応力状態・力学環境の定量化を図る.すなわち,従来の分子生物学的視点にはないバイオメカニクス的視点を併せて導入する.このような複眼的アプローチにより細胞の力覚機構の解明を目指す.
文 献
[1] Murakoshi M, Gomi T, Iida K, Kumano S, Tsumoto K, Kumagai I, Kobayashi T, and Wada H. Imaging by atomic force microscopy of the plasma membrane of prestin-transfected Chinese hamster ovary cells. J Assoc Res Otolaryngol 7, 267-278, 2006.
[2] Kumano S, Iida K, Murakoshi M, Naito N, Tsumoto K, Kobayashi T, Ikeda K, Kumagai I, Kobayashi T, and Wada H. Effects of mutation in the conserved GTSRH sequence of the motor protein prestin on its characteristics. JSME Int J 48C, 403-410, 2005.
[3] Andoh M, Nakajima C, and Wada H. Phase of neural excitation relative to basilar membrane motion in the organ of corti: Theoretical considerations. J Acoust Soc Am 118, 1554-1565, 2005.