分担研究概要

細胞の力覚機構の解明
佐藤 正明
医工学研究科 医工学専攻 生体機械システム医工学講座
生体力学研究分野 教授
E-mail:![]()
1. はじめに
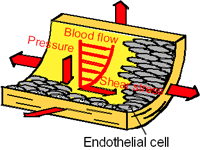
図1 内皮細胞に作用する力学刺激
我々の身体を構成する細胞の多くは力の大きさや方向を感知するセンサ”すなわち力覚(メカノセンサ)”を有している.例えば,血管内腔面に存在する血管内皮細胞は血流によるせん断応力,壁の変形による張力,血圧による静水圧力を絶えず受けており(図1),その力学環境に適応するように形態や機能を変化させる [1].また,いわゆる感覚器として皮膚の感覚細胞,骨格筋の筋紡錘,聴覚系の有毛細胞などが力学刺激を感知する機能を有していることは言うまでもなく,その機構解明に関する研究は多く見られる.このように我々の体内には力覚を持つ細胞が至る所に存在し,生命維持において重要な役割を果たしている.しかしながら,通常,感覚として意識されない力学刺激の感知において,細胞の力覚機構の詳細は明らかになっていない.
細胞の力学応答に関するこれまでの研究は主として分子生物学,生化学などの立場から行われており,細胞内に普遍的に伝わる信号を想定したものである.内皮細胞は流れの方向に伸長・配向するといった力学刺激に対する指向性を示すが,上記のアプローチのみでは作用した力の方向に応じて細胞が応答するという結果を十分に説明できない.多くの細胞は力学刺激を負荷すると細胞骨格の再構築を行い,力の方向に応答した形態を示す.血管内皮細胞を対象とした我々のこれまでの研究から,細胞がせん断応力を感知して形態変化を起こす場合,(1)ストレスファイバの消失,(2)葉状仮足の形成,(3)焦点接着斑の配置,(4)ストレスファイバの発達・形成,として特徴付けられる時間経過を辿ることが明らかになってきた.また,細胞間接着タンパク質であるVEカドヘリンの発現も流れに対する細胞の形態変化と密接に関係することを見出している(図2).
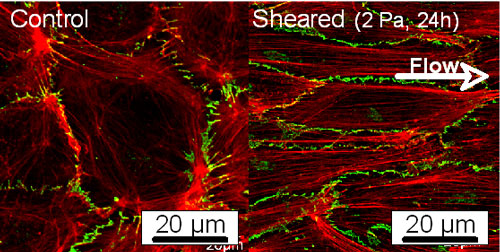
図2 せん断応力負荷前後のアクチンフィラメント(赤)とVEカドヘリン(緑)
以上の結果より,細胞の形態を決定する因子はストレスファイバの配向とそれを支える細胞間接着もしくは焦点接着斑であると考えられる.そこで本研究では,力覚の部位としてストレスファイバ,細胞間接着部位,焦点接着斑が主たる候補とする仮説を掲げ,検証する.外力としてせん断応力,張力,静水圧を想定し,これらの力学条件下で機能する血管内皮細胞を主に対象として,細胞の力覚部位とその機構を明らかにすることを目的とする.
2. 研究計画
2.1 力学刺激を負荷した内皮細胞におけるタンパク質のライブイメージング
遺伝子導入法を用いて, VEカドヘリンまたは焦点接着斑形成タンパク質の一部であるFAT(Focal Adhesion Targeting)ドメインを RFP(Red Fluorescent Protein)により可視化し,内皮細胞にせん断応力または張力刺激を負荷した際のライブイメージングを行う.また細胞の形態を決定する重要な要素であるアクチンフィラメントの動的挙動を同時に観察するため,GFP(Green Fluorescent Protein)-アクチンベクターの導入も同時に行う.焦点接着斑に関しては,焦点接着斑の移動・配置に関与していると考えられる微小管の分布も併せて確認する.さらに形態変化時において葉状仮足形成を制御しVEカドヘリン依存細胞間接着および焦点接着斑の形成・配置等に関与していると考えられるRhoファミリーの活性局在にも焦点を当てる.
2.2 細胞間接着部位への局所力学刺激負荷実験
GFP-アクチンベクターを遺伝子導入した内皮細胞に対してマイクロピペットにより局所的な引張刺激を負荷する.細胞間接着部位を介した情報伝達により周囲の細胞に引き起こされる形態変化ならびにストレスファイバの構造変化を確認する(図3).またシグナリングタンパク質であるであるSHP-2の細胞間接着部位への局在を併せて調べることで,細胞間接着部位のメカノセンサとしての役割を検討する.
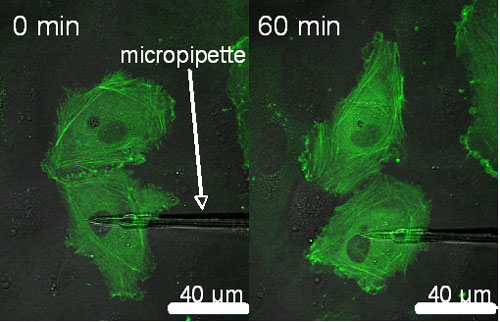
図3 マイクロピペットによる局所力学刺激負荷前後のアクチンフィラメント
2.3 単離ストレスファイバを用いた引張試験

図4 単離ストレスファイバの引張試験
流れを負荷した内皮細胞において最初に引き起こされる反応はストレスファイバの切断と消失であり[2],これはストレスファイバが力の方向をも含んだセンサとして機能している可能性を示唆している.我々は最近の研究から,培養平滑筋細胞より単離したストレスファイバに対して引張試験を行うことができるシステムを開発した(図4)[3,4].本システムを用いて,ストレスファイバへの張力を調整しながらストレスファイバ分解に関わるコフィリンの作用を調べることでストレスファイバのメカノセンサとしての役割について検討する.
2.4 バイオMEMS技術を用いた細胞まわりの局所力学環境操作デバイスの開発
従来の細胞への力学刺激負荷実験系はいわゆるマクロな力学環境操作であったが,力覚機構の解明のためには単一細胞のスケールに応じた実験系が望まれる.そこで局所せん断応力,静水圧の負荷実験系としてマイクロ流路を製作する.流路の微小化により細胞まわりの流れ,圧力環境をより詳細に制御できる.開発した局所力学環境操作デバイスとライブイメージング技術を組み合わせ,従来にはない細胞力覚機構解明へ向けた新しい実験系を構築する.本デバイスを用いた局所力学環境操作では単一細胞まわりの力学環境を詳細に定量化できるため,力学刺激と細胞応答性を定量的に関係付けることができる.
3. おわりに
以上の通り,ライブイメージング等の分子生物学的細胞観察技術,細胞内小器官のバイオメカニクス的計測技術およびミクロな力学環境操作のためのバイオMEMS技術を高度に融合させ,特に次の項目に着目して細胞応答性の評価を行う.(1)細胞および細胞骨格構造の形態,(2)細胞骨格タンパク質,接着タンパク質など分子レベルの移動・分布,(3)細胞内小器官の力学特性,(4)細胞内部の応力状態・力学環境の定量化を図る.すなわち,従来の分子生物学的視点にはないバイオメカニクス的視点を併せて導入する.このような複眼的アプローチにより細胞の力覚機構の解明を目指す.
参考文献
[1] Davies P, Physiol Rev 75, 519-560, 1995
[2] McCue S, et al. Trends Cardiovasc Med 14, 143-151, 2004
[3] Deguchi S, et al. Molec & Cell Biomech 2, 125-134, 2005
[4] Deguchi S, et al. J Biomech 39, 2603-2610, 2006